化合物の安全性を実験データにより探索・検証し、開発・承認・育薬をサポート
安全性研究機能のミッションは、大きく2つあります。1つは、探索研究段階から創薬ターゲット分子に由来する毒性の検証と、候補薬の構造や特有の機能に由来するオフターゲットの毒性の検証をすべてのプロジェクトで行い、それにより創薬コンセプトの構築、薬のデザインの最適化、開発品の選択に貢献すること。薬のデザインの最適化には、懸念される毒性の原因となる候補薬の化学構造を特定し、毒性を回避する構造変換の方向性を見出す仕事も含まれます。そして2つ目は、開発候補薬決定後、臨床試験での安全性を非臨床実験データでサポートし、候補薬を世界に送り出すことです。
探索創薬段階ではターゲット分子の生体作用に起因する毒性、それ以外の生体機能に及ぼす作用を生物学的に検討します。スクリーニングでは、in silicoでの毒性予測、自動化アッセイによる構造活性相関取得や、ヒト由来細胞を利用したin vitro実験などで効率よく候補検体の選定を実施します。早期の小規模な動物実験では網羅的な遺伝子発現解析データも利用して、生体に及ぼす毒性とその発現メカニズムを探索研究段階で把握することに注力しています。時には正常動物に加えて遺伝子改変モデルについても詳細な解析を実施し、生体における複雑な分子メカニズムを様々なデータから評価していきます。
また、バイオ医薬品では免疫系の変化が誘導されやすいため、適切なヒトin vitro免疫機能評価系を新規技術の開発と融合させながら構築し、毒性懸念の洗い出しやよりよい分子設計への貢献を行っています。これらのアッセイ系には、ロシュ・グループ内で協働して開発し、シェアしているものもあります。
洗い出された毒性課題は、その分子メカニズムや種差・ヒト外挿性についてさらに検討するとともに、毒性バイオマーカーを探索し、治験を安全に行うための方法も考えます。また、ヒト副作用予測のためにヒトiPS細胞や生体模倣システム(Microphysiological System:MPS)等を用いた研究にも取り組んでいます。
臨床開発候補化合物が決定された後は、ヒトに安全に投与するためのデータを取得し、リスクアセスメントを行ってグローバルな臨床開発と承認申請、市販後の安全性確保をサポートします。以上のように探索研究段階から、薬を世に送り出し、医療現場への浸透まで、ヒトへの外挿性を意識したバイオロジーを通して、全てのステージで全てのプロジェクトと向き合うのが安全性研究です。
以上に加えて、ヒト試料を用いた薬剤標的分子の探索、モデル動物とヒト疾患の相関の解析、さらには臨床試験で得られる病理サンプル等を用いた有効性バイオマーカー探索や解析も、安全性研究の活動に含まれます。
Researcher's Voice

田中 美咲Tanaka-Misaki
獣医学研究科 博士課程 修了
2020年入社
専門性を磨き、患者さんのためになる薬を。
安全性研究の発展につながる仕事をしたい
現在の仕事・自身の役割は?
創薬の比較的早い段階から、化合物の安全性評価をしています。一般毒性試験(in vivo)やin vitro毒性ポテンシャル評価(骨髄毒性、肝臓毒性)について試験計画の立案から実験、データ分析まで携わっています。今まさに進行中のプロジェクトの安全性評価を実施する合間に、将来の安全性評価の質を高めるための基礎研究にも取り組んでいます。
具体的にどのような研究を?
一般毒性試験の実施にあたっては、被験化合物の情報を収集し予想される毒性学的変化や変化が現れる用量を推測し、適切な投与・評価計画を立案します。実際の試験中は動物への被験物質投与、観察、各種検査を部内外のメンバーと協力して進めます。得られたデータを取りまとめて部内展開し、ヒトでの安全性リスクにつながりうる変化の見落としがないようにレビューと議論のかじ取りを行います。In vitro評価では、特定の毒性ポテンシャルが評価対象となりますが、できる限りヒトでのリスク予測につなげること、定量的な結果を得ることを目指して実験をデザインしています。
やりがいやおもしろさは?
薬のタネは安全性評価にたどり着くまでに薬効や動態面である程度絞り込まれており、私たちが手にする検体はプロジェクトチームの期待が高いものが多いと感じます。また安全性評価をクリアした検体は薬として利用されることに一歩大きく近づくと思います。このことは大きなモチベーションであると同時に、安全性担保のためのプレッシャーにもなっており、毎日真剣にデータと向き合うことにつながっています。
職場環境の特徴や魅力は?
一言に安全性と言っても、毒性の種類や標的組織によってさまざまな専門家が集まっています。じつにいろいろな案件が飛び込んでくるので日々忙しくしていますが、裁量労働制度をよく理解し在宅勤務を有効活用すれば、フレキシブルな働き方が許される環境だと思います。
将来の目標は?
まずは今関わっている分野で、トキシコロジスト・サイエンティストとしての専門性を磨きたいと考えています。その過程で患者さんのためになる素晴らしい薬の開発と、安全性研究の発展につながるような仕事ができるように努力したいと思います。
主な研究テーマ
- バイオロジー研究を通じたターゲット作用及び毒性メカニズムの解明
- 安全性スクリーニングおよび新規評価技術開発
- 臨床適用を見据えた毒性バイオマーカ―探索
- 非臨床安全性研究戦略立案と各安全性試験の遂行・評価
- モデル動物の病態病理解析
- ヒト組織標本を用いた薬剤ターゲットならびに有効性バイオマーカー探索
- 医療現場とのコミュニケーションに基づいた育薬
基盤となる技術
- フローサイトメトリー(FACS: Fluorescence Activated Cell Sorting)
蛍光抗体法を利用して細胞特性を解析し、特定の細胞を分取する手法であり、特に免疫細胞について解析することで、免疫系に作用して薬理作用を示すバイオ医薬品の安全性評価に活用することができる。 - In vivo毒性評価
開発ステージに合わせ各種動物種で、臨床検査、病理評価を駆使して総合的に生物反応を評価する。 - トキシコゲノミクス
RNA-SeqによりmRNA発現を網羅的に測定し、毒性につながる生物反応の確認や毒性発現メカニズム解析等に活用している。 - iPS細胞を用いた評価
ヒトiPS細胞は様々な臓器の細胞に分化誘導可能であり、臨床予測性の高い毒性評価系を構築し、候補分子を評価している。 - Immunohistochemistry
病理組織標本上に存在する蛋白質を、特異抗体を用いて染色する技術。この技術により、標的分子を発現する組織や細胞を知ることができる。
研究機器・設備・施設
- 超高解像度顕微鏡

光学顕微鏡の分解能を超えた解像度で、蛍光染色された組織標本が観察できる。
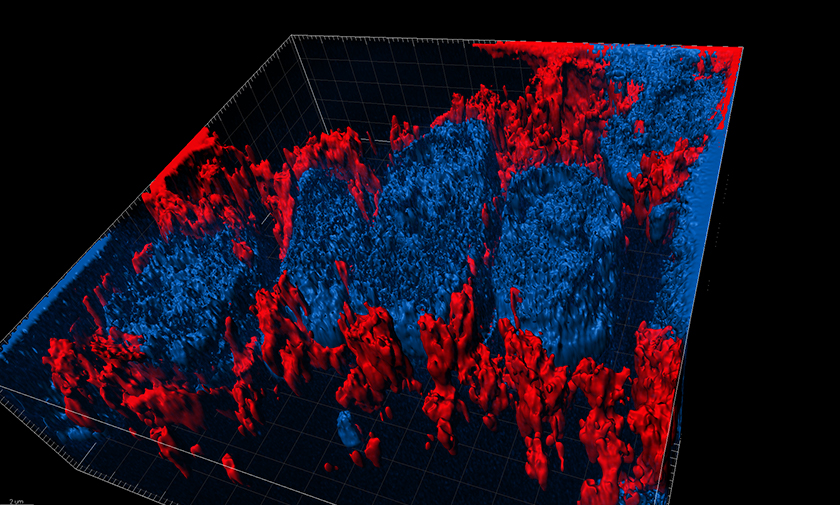
超高解像度画像
- Whole Slide Imaging Scanner

スライドグラス上の病理組織標本をスキャンし、画像を電子化する機器。この電子化された画像を得ることで、AIを駆使した画像解析アルゴリズムによる解析が可能となる。